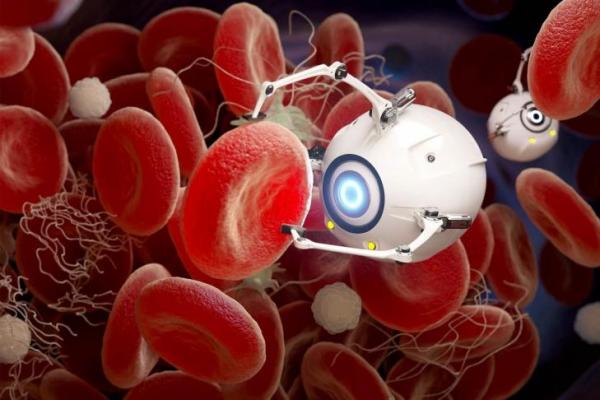
Nanorobot pembunuh sel-sel kanker (Foto: Earth)
Jakarta, Jurnas.com - Salah satu kelemahan utama terapi kanker modern adalah ketidaktepatan sasaran. Banyak obat antikanker beredar ke seluruh tubuh, tetapi hanya sebagian kecil yang benar-benar mencapai sel tumor. Hambatan aliran darah dan jaringan membuat sebagian besar partikel obat tersesat sebelum tiba di target.
Penelitian terbaru menawarkan pendekatan berbeda. Alih-alih membiarkan obat mengalir pasif di dalam tubuh, para ilmuwan kini mengembangkan partikel nano yang dapat bergerak sendiri dan mencari tumor secara aktif dengan memanfaatkan kimia alami tubuh manusia.
Dikutip dari Earth pada Jumat (23/1), tim peneliti dari Wuhan University of Technology sedang mengembangkan partikel yang sering disebut sebagai nanorobot suntik.
Partikel ini dirancang untuk mendorong dirinya sendiri di dalam cairan tubuh, sekaligus mengenali sinyal kimia khas yang dihasilkan oleh jaringan kanker.
Penelitian ini dipimpin oleh Dr. Jianguo Guan, ilmuwan yang mempelajari partikel nano bertenaga enzim. Pada 2025, dia ikut menulis studi yang memperkenalkan nanorobot pembawa obat yang mampu bergerak mandiri di dalam sistem biologis.
Dasar desain nanorobot ini adalah partikel emas berukuran sangat kecil yang dibagi menjadi dua sisi dengan fungsi berbeda. Struktur semacam ini dikenal sebagai nanopartikel Janus, dinamai dari dewa Romawi bermuka dua, karena setiap sisi memiliki peran kimia tersendiri.
Pada satu sisi partikel, para peneliti menempelkan enzim urease. Enzim ini memecah urea menjadi senyawa yang lebih sederhana, menciptakan ketidakseimbangan kimia di sekitar partikel yang menghasilkan dorongan maju.
Sisi lainnya dilapisi enzim katalase, yang memecah hidrogen peroksida menjadi air dan oksigen. Oksigen yang terbentuk menghasilkan dorongan kecil yang berfungsi sebagai sistem kemudi, membantu partikel bergerak ke arah tertentu.
Penggunaan bahan bakar alami menjadi kunci pendekatan ini. Urea sudah tersedia secara alami dalam aliran darah, sehingga nanorobot tidak membutuhkan bahan bakar tambahan yang berpotensi beracun. Menariknya, jaringan tumor cenderung memiliki kadar urea yang lebih tinggi dibanding jaringan sehat.
Dorongan saja tidak cukup untuk membuat nanorobot efektif. Tanpa arah yang jelas, partikel akan bergerak acak dan kehilangan efisiensi. Karena itu, sistem kemudi berbasis katalase menjadi sangat penting.
Sel kanker diketahui menghasilkan lebih banyak hidrogen peroksida akibat stres metabolik. Perbedaan konsentrasi senyawa ini menciptakan gradien kimia yang dapat “diikuti” oleh nanorobot, sebuah mekanisme yang dikenal sebagai kemotaksis.
Dengan kemotaksis, nanorobot bergerak menuju konsentrasi hidrogen peroksida yang lebih tinggi, yang biasanya menandai keberadaan tumor. Mekanisme ini membantu partikel menghindari perjalanan sia-sia dan meningkatkan peluang mencapai target.
Tantangannya, pada skala nano, partikel terus-menerus bertabrakan dengan molekul di sekitarnya. Tanpa dorongan yang cukup kuat, gerakan dapat terhenti atau menyimpang. Inilah sebabnya nanopartikel pasif sangat tidak efisien; penelitian sebelumnya menunjukkan kurang dari 1 persen partikel mencapai tumor padat.
Dalam uji coba pada tikus yang memiliki tumor, nanorobot ini menunjukkan kinerja jauh lebih baik. Partikel aktif tersebut bergerak menuju sinyal kimia tumor, menembus jaringan lebih dalam, dan masuk ke dalam sel kanker dalam jumlah jauh lebih besar dibanding partikel pasif.
Ketika membawa obat antikanker, nanorobot menghasilkan efek penekanan tumor yang sekitar 49 kali lebih kuat dibandingkan sistem pengantaran pasif pada model yang sama. Hasil ini menunjukkan bahwa lebih banyak obat benar-benar mencapai lokasi yang diinginkan.
Keberhasilan tidak hanya bergantung pada mencapai tumor, tetapi juga pada kemampuan masuk ke dalam sel. Dengan penetrasi jaringan yang lebih dalam, nanorobot meningkatkan peluang masuk ke sel kanker melalui proses endositosis, yaitu mekanisme alami sel untuk menelan partikel.
Setelah berada di dalam sel, kondisi lingkungan seperti keasaman dan enzim tertentu dapat melemahkan lapisan pembungkus partikel, sehingga obat dilepaskan dan mulai bekerja. Namun, pengaturan waktu pelepasan ini tetap menjadi tantangan besar.
Dari sisi keamanan, tim peneliti memantau berat badan, kimia darah, dan kondisi organ tikus percobaan. Pada dosis yang diuji, tidak ditemukan tanda kerusakan signifikan. “Hasil ini secara keseluruhan menunjukkan bahwa nanorobot memiliki tingkat keamanan biologis yang baik di dalam tubuh,” tulis Dr. Guan.
Meski menjanjikan, perjalanan menuju aplikasi klinis masih panjang. Produksi massal yang konsisten, studi keamanan jangka panjang, serta bukti bahwa tumor manusia memiliki sinyal kimia yang cukup kuat masih perlu dikonfirmasi.
Namun konsep menggabungkan sistem pendorong dan kemudi dalam satu partikel suntik membuka peluang baru dalam pengobatan kanker. Dengan memanfaatkan sinyal kimia tubuh sendiri, nanorobot berpotensi meningkatkan efektivitas terapi tanpa memerlukan alat eksternal.
Studi ini telah dipublikasikan dalam jurnal ilmiah National Science Review.
Google News: http://bit.ly/4omUVRy
Terbaru: https://jurnas.com/redir.php?p=latest
Langganan : https://www.facebook.com/jurnasnews/subscribe/
Youtube: https://www.youtube.com/@jurnastv1825?sub_confirmation=1
nanorobot kanker terapi kanker target teknologi nano medis